Su, hidrojen ve oksijen kimyasal elementlerinden oluşan ve gaz, sıvı ve katı halde bulunan bir maddedir. Bileşiklerin en bol ve en gerekli olanlarından biridir. Oda sıcaklığında tatsız ve kokusuz bir sıvıdır, diğer birçok maddeyi önemli ölçüde çözme kabiliyetine sahiptir. Aslında, bir çözücü olarak suyun çok yönlülüğü, canlı organizmalar için çok önemlidir. Yaşamın, dünya okyanuslarının sulu çözeltilerinden kaynaklandığına inanılıyor ve canlı organizmalar, biyolojik işlemler için kan ve sindirim sıvıları gibi sulu çözeltilere bağlıdır. Küçük miktarlarda su renksiz görünür, ancak su aslında kırmızı dalga boylarında hafif ışığın emilmesinden kaynaklanan kendine özgü bir mavi renge sahiptir.
Su molekülleri yapı olarak basit (H 2 O) olmasına rağmen, bileşiğin fiziksel ve kimyasal özellikleri olağanüstü derecede karmaşıktır ve Dünya’da bulunan çoğu madde için tipik değildir. Örneğin, suyun hacmi, bilinen tüm sıvı ların aksine, belirli bir sıcaklığa (+4°C’ye) düşene kadar azalır, daha sonra tekrar artmaya başlar. Donduğunda ise hacmi sıvı hale göre daha fazladır. Bu yüzden buz, suyun dibine batmayıp su üstünde yüzer. Hemen hemen tüm diğer bileşikler için katı hal, sıvı halden daha yoğundur; böylece katı, sıvının dibine batar. Buzun su üzerinde yüzmesi son derece önemlidir çünkü dünyanın soğuk bölgelerindeki gölet ve göllerde oluşan buz, aşağıdaki su yaşamını koruyan bir yalıtım bariyeri görevi görür. Buz sıvı sudan daha yoğun olsaydı, bir havuzda oluşan buz batardı ve böylece soğuk sıcaklığa daha fazla su maruz kalırdı. Böylece, gölet eninde sonunda donarak mevcut tüm yaşam formlarını öldürürdü. Suyun kolayca buhara (gaza) dönüşmesi, atmosfer yoluyla okyanuslardan yoğunlaştığı iç bölgelere taşınmasına izin verir ve yağmur olarak bitki ve hayvan yaşamını besler.
Suyun Yapısı
Sıvı hal
Su molekülü iki bileşenden oluşur. Bunlar, her biri tek bir kimyasal bağ ile bir oksijen atomuna bağlanan hidrojen atomlarıdır. Çoğu hidrojen atomunun yalnızca bir protondan oluşan bir çekirdeği vardır. İki izotopik form, atom çekirdeğinin de sırasıyla bir ve iki nötron içerdiği döteryum ve trityum, suda küçük bir dereceye kadar bulunur. Döteryum oksit (D 2 O), adı verilen ağır su, kimyasal araştırmalarda önemlidir ve bazı nükleer reaktörlerde nötron moderatörü olarak da kullanılır.
Formülü (H 2 O) basit görünmesine rağmen, su çok karmaşık kimyasal ve fiziksel özellikler sergiler. Örneğin, erime noktası 0 °C (32 °F) ve kaynama noktası 100 °C (212 °F), hidrojen sülfür ve amonyak gibi benzer bileşiklerle karşılaştırıldığında beklenenden çok daha yüksektir. Katı haliyle, buzda su, sıvı olduğu zamandan daha az yoğundur, bu da alışılmadık bir özelliktir. Bu anormalliklerin kökünde su molekülünün elektronik yapısında yatmaktadır.
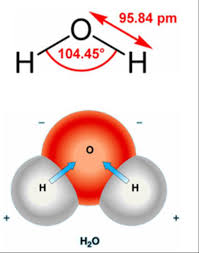
Su molekülü doğrusal değildir, ancak özel bir şekilde bükülmüştür. İki hidrojen atomu oksijen atomuna 104,5 derecelik açıyla bağlanmıştır. O ― H mesafesi (bağ uzunluğu) 95,7 pikometredir. (9,57 x 10 −11 metre veya 3,77 x 10 −9 inç). Bir oksijen atomunun bir hidrojen atomundan daha büyük bir elektronegatifliği olduğundan, su molekülündeki O ― H bağları, oksijen kısmi bir negatif yük (δ−) ve hidrojenler kısmi bir pozitif yüke (δ +) sahip olmak üzere kutupsaldır.
Su moleküllerindeki hidrojen atomları, yüksek elektron yoğunluğuna sahip bölgelere çekilir ve bu bölgelerle zayıf bağlar olarak bilinen hidrojen bağlarını oluşturabilir. Bu, bir su molekülündeki hidrojen atomlarının, bitişik bir su molekülü üzerindeki oksijen atomunun bağlanmayan elektron çiftlerine çekildiği anlamına gelir. Sıvı suyun yapısının, sürekli olarak oluşan ve yeniden oluşan su molekülleri kümelerinden oluştuğuna inanılmaktadır. Bu kısa menzilli düzen adı verilen, yüksek viskozite ve yüzey gerilimi gibi diğer olağandışı su özelliklerini açıklar.
Bir oksijen atomunun dış ( değerlik ) kabuğunda toplam sekiz elektron tutabilen altı elektron vardır. Bir oksijen atomu tek bir kimyasal bağ oluşturduğunda, kendi elektronlarından birini başka bir atomun çekirdeğiyle paylaşır ve karşılığında o atomdan bir elektron payını alır. İki hidrojen atomuna bağlandığında, oksijen atomunun dış elektron kabuğu dolar.

Katı Hal (Buz)
Katı halde (buz), moleküller arası etkileşimler, her bir oksijen atomunun dört hidrojen atomu ile çevrili olduğu oldukça düzenli ancak gevşek bir yapıya yol açar; bu hidrojen atomlarından ikisi kovalent olarak oksijen atomuna bağlıdır ve diğer ikisi (daha uzun mesafelerde) oksijen atomunun paylaşılmamış elektron çiftlerine hidrojene bağlıdır.
Buzun bu açık yapısı, yoğunluğunun, sıralı yapının kısmen parçalandığı ve su moleküllerinin (ortalama olarak) birbirine daha yakın olduğu sıvı halinkinden daha az olmasına neden olur. Su donduğunda, koşullara bağlı olarak çeşitli yapılar mümkündür. On sekiz farklı buz biçimi bilinmektedir ve farklı dış basınç ve sıcaklıklarla değiştirilebilir.
Gaz Hal
Suyun üçüncü hali, gaz halidir (su buharı). Bu durumda su molekülleri çok hızlı hareket eder ve birbirine bağlı değildir. Suyu gaz halinde görünmez ancak sıcak ve nemli bir günde havada hissedebilir. Genellikle su 100 ° C veya 212 ° F sıcaklıkta kaynayarak su buharı oluşturur. Birçok insan, kaynayan bir su ısıtıcısından çıkan görünür buhar dumanının su buharı olduğuna inanır. Bununla birlikte, gördüğünüz buhar, havada asılı duran çok küçük su damlacıklarından oluşurken, su buharı, su buharlaştığında ortaya çıkan görünmez gazdır. Kızılötesi algılama cihazlarının elektromanyetik gözlerinden su buharı görebilir.
Suyun Sıvı Yapısının Önemi
Suyun sıvı hali çok karmaşık bir yapıya sahiptir ve şüphesiz moleküllerin önemli ölçüde birleşmesini içerir. Sıvı sudaki moleküller arasındaki yoğun hidrojen bağı, viskozite, yüzey gerilimi ve kaynama noktası gibi özellikler için, küçük moleküller içeren tipik bir sıvı için beklenenden çok daha büyük değerler üretir. Örneğin, moleküllerinin boyutuna bağlı olarak, suyun gözlemlenen kaynama noktasından yaklaşık 200 ° C (360 ° F) daha düşük bir kaynama noktasına sahip olması beklenir. Su molekülleri arasında yoğun bir birliktelik sergileyen suyun yoğunlaşmış hallerinin (katı ve sıvı) aksine, gaz halindeki (buhar) fazı, birbirinden büyük mesafelerde nispeten bağımsız su molekülleri içerir.
Su molekülünün polaritesi, sulu çözeltilerin oluşumu sırasında iyonik bileşiklerin çözünmesinde önemli bir rol oynar. Dünya okyanusları, büyük miktarda çözünmüş tuz içerir ve bu da harika bir doğal kaynak sağlar. Bunun yanında organizmaları canlı tutmak için her an meydana gelen yüzlerce kimyasal reaksiyon, sulu sıvılarda gerçekleşir.
Maddelerin sudaki çözünürlüğü son derece karmaşık bir süreç olmasına rağmen, polar su molekülleri ile çözünen madde (yani çözünen madde) arasındaki etkileşim önemli bir rol oynar. Ne zaman iyonik katı suda çözünür, su moleküllerinin pozitif uçları anyonlara çekilirken, negatif uçları katyonlara çekilir. Bu sürece dehidrasyon denir. İyonlarının hidrasyonu, bir tuzun suda parçalanmasına (çözünmesine) neden olma eğilimindedir. Çözünme sürecinde, katının pozitif ve negatif iyonları arasında bulunan güçlü kuvvetlerin yerini güçlü su-iyon etkileşimleri alır.
İyonik maddeler suda çözündüğünde, ayrı ayrı katyonlara ve anyonlara ayrılırlar. Örneğin, ne zaman sodyum klorür (NaCl) suda çözünürse, elde edilen çözelti ayrılmış Na + ve Cl – iyonları içerir.
Genel olarak, bir iyonun yük yoğunluğu (yükün yüzey alanına oranı) ne kadar büyük olursa, hidrasyon sayısı o kadar büyük olacaktır. Kural olarak, negatif iyonlar, su moleküllerinin hidrojen atomları anyona doğru yöneldiğinde meydana gelen daha büyük kalabalık nedeniyle, pozitif iyonlardan daha küçük hidrasyon sayılarına sahiptir.
Çoğu iyonik olmayan bileşik de suda çözünür. Örneğin, şarap, bira ve damıtılmış alkollü içkilerin alkollü bileşeni olan etanol (C 2 H 5 OH) suda oldukça çözünür. Bu içecekler, diğer maddelerle birlikte sulu çözelti içinde değişen oranlarda etanol içerir. Alkol molekülünün yapısı nedeniyle etanol suda çok çözünür. Molekül, sudakine benzer bir polar O ― H bağı içerir ve bu da suyla etkili bir şekilde etkileşime girmesine izin verir.
Su, “evrensel çözücü” olduğu için her şeyi çözer. Su, birçok maddeyi çözme yeteneğine sahiptir, ancak “evrensel çözücü” terimi yanıltıcıdır. Su, şekerler ve tuzlar gibi diğer polar molekülleri ve iyonları çözebilir. Bununla birlikte, yağlar gibi polar olmayan moleküller, kısmi pozitif veya kısmi negatif yüklerden yoksundur, bu nedenle su moleküllerine çekilmezler. Bu nedenle yağ gibi polar olmayan maddeler suya eklendiğinde ayrı kalır.
Suyun Fiziki Özellikleri
Suyun birkaç önemli fiziksel özelliği vardır. Suyun her yerde bulunmasından dolayı bu özellikler aşina olmasına rağmen, suyun fiziksel özelliklerinin çoğu oldukça atipiktir. Kurucu moleküllerinin düşük molar kütlesi göz önüne alındığında, su alışılmadık derecede büyük viskozite, yüzey gerilimi, buharlaşma ısısı ve buharlaşma entropisi değerlerine sahiptir ve bunların tümü sıvı suda bulunan kapsamlı hidrojen bağlanma etkileşimlerine atfedilebilir . Maksimum hidrojen bağlanmasına izin veren açık buz yapısı, nedeni ile katı su, sıvı sudan daha az yoğundur. Bu da yaygın maddeler arasında oldukça sıra dışı bir durumdur.
Özetle;
- Su kutupsaldır. Su molekülleri, hidrojenler üzerinde kısmi pozitif yükler, oksijen üzerinde kısmi bir negatif yük ve bükülmüş bir genel yapı ile kutupsaldır. Bunun nedeni, oksijenin daha elektronegatif olmasıdır, yani elektronları çekmede hidrojenden daha iyidir.
- Su mükemmel bir çözücüdür. Su, birçok polar ve iyonik maddeyi çözme konusunda benzersiz bir yeteneğe sahiptir. Bu, tüm canlılar için önemlidir. Çünkü su, su döngüsünden geçerken birçok değerli besini de beraberinde alır.
- Su yüksek ısı kapasitesine sahiptir. Belirli bir miktardaki suyun sıcaklığını bir derece yükseltmek çok fazla enerji gerektirir, bu nedenle su, ortamdaki sıcaklığın düzenlenmesine yardımcı olur. Örneğin, bu özellik, bir havuzdaki suyun sıcaklığının değişen atmosferik sıcaklıktan bağımsız olarak gündüzden geceye göreceli olarak sabit kalmasını sağlar.
- Su, yüksek buharlaşma ısısına sahiptir. İnsanlar (ve terleyen diğer hayvanlar) serinlemek için suyun yüksek buharlaşma ısısını kullanır. Buharlaşma ısısına ulaşıldığında su sıvı halinden buhara dönüştürülür. Ter, çoğunlukla sudan oluştuğu için, buharlaşan su, atmosfere salınan fazla vücut ısısını emer. Bu, buharlaşmalı soğutma olarak bilinir.
- Su, yapışkan özelliklere sahiptir. Su molekülleri, birbirleriyle hidrojen bağı oluşturma yeteneklerinden dolayı güçlü kohezif kuvvetlere sahiptir. Kohezif kuvvetler, yüzey geriliminden, bir sıvının yüzeyinin gerilim veya stres altına yerleştirildiğinde kırılmaya direnme eğiliminden sorumludur. Su ayrıca kendi dışındaki maddelere de yapışmasına izin veren yapışkan özelliklere sahiptir. Bu birleşik ve yapışkan özellikler, birçok yaşam biçiminde sıvı taşınması için gereklidir. Örneğin, besinlerin yer çekimine karşı bir ağacın tepesine taşınmasına izin verirler.
- Su katı haldeyken sıvı haline göre daha az yoğundur. Su donarken moleküller, molekülleri sıvı sudan daha fazla ayıran kristal bir yapı oluşturur. Bu, buzun sıvı sudan daha az yoğun olduğu anlamına gelir, bu yüzden yüzer.
- Bu özellik, göletlerin, göllerin ve okyanusların donmasını önlediği ve yaşamın buzlu yüzey altında gelişmeye devam etmesine izin verdiği için önemlidir.







Yorum ekle